Испарение

О чем эта статья:
Испарение: что это за процесс
Процесс перехода из жидкого состояния в газообразное называется парообразованием. У этого процесса есть две разновидности: испарение и кипение.
Например, мы заварили себе горячий чай. Над чашкой мы точно увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. Это действительно так, при этом эти два процесса могут происходить параллельно.
- Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
- Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха — из-за разницы температур происходит испарение. Как будто бы это фазовый переход, о котором мы говорим в статье об агрегатных состояниях .
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Интересно то, что направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
Подытожим, чтобы не запутаться: в чем главная разница между испарением и кипением:
| Испарение | Кипение |
| При любой температуре, с поверхности жидкости | При определенной температуре, во всем объеме жидкости |
Испарение на уровне молекул
Давайте вспомним об особенностях разных агрегатных состояний вещества.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
Из этой таблицы видно, что молекулы в жидкостях находятся близко друг другу, но хаотично, то есть не имеют кристаллической решетки, как в твердых телах. Эти молекулы движутся (причем, чем выше температура, тем быстрее движутся) и в ходе движения сталкиваются. Столкновения меняют направление и скорость движения — из-за этого молекулы иногда быстро устремляются к поверхности жидкости и вылетают из нее. Это и есть испарение.
В предыдущем абзаце мы не случайно заметили, что молекулы движутся быстрее при увеличении температуры — ведь из-за этого испарение идет интенсивнее. В этом случае происходит охлаждение: нагретую жидкость уже покинули все самые быстрые молекулы и температура самой жидкости понижается.
Интенсивность испарения
Интенсивностью испарения называют количество воды, которое испаряется с поверхности площадью 1 см2 за одну секунду.
Интенсивность испарения зависит от следующих факторов:
- Температура поверхности. Чем выше температура, тем больше испарение. После дождя в Санкт-Петербурге улицы долгое время остаются влажными, а вот в Таиланде даже в сезон дождей все высыхает быстро — из-за высокой температуры. Но это только если в сезон дождей дождь умудрился прекратиться

- Ветер. Чем больше скорость ветра, тем больше испарение. Фен для волос работает на этом принципе — по сути, он создает портативный ветер, который помогает высушить ваши волосы.
- Дефицит влажности. Интенсивность испарения будет выше там, где больше дефицит влажности. Вряд ли многие из нас были Сахаре, но что это такое представляют все. В любой пустыне колоссально низкая влажность — из-за этого испарение идет интенсивнее.
- Давление. Чем больше давление, тем меньше испарение. Мы уже выяснили, что не смотря на разницу между кипением и испарением, эти два процесса между собой связаны. Таким образом, температура кипения воды на вершине Эвереста равна 69 градусам Цельсия. В то время, как в нашей повседневной жизни она равна 100. Это возвращает нас к первому фактору — температуре.
Скорость испарения — количество жидкости, которая испаряется со свободной поверхности в единицу времени.
Интенсивность испарения — количество жидкости, которая испаряется с единицы площади поверхности в единицу времени.
По сути, это два очень близких друг к другу понятия, поэтому разница будет лишь в величинах и единицах измерения, а суть процесса отражают обе формулировки.
Насыщенный пар
Процесс испарения напрямую связан с круговоротом воды в природе. Вода, испаряясь, превращается в водяной пар и поднимается вверх, где происходит конденсация пара, образуются облака, и вода возвращается на землю в виде осадков.
Вследствие конденсации водяного пара, который живет в воздухе, образуются облака и туман. По этой же причине холодное стекло запотевает, соприкасаясь с теплым воздухом.
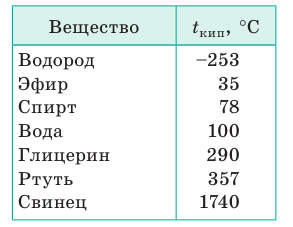
На рисунке — процессы испарения и конденсации в плотно закрытом сосуде, когда жидкость и пар находятся в динамическом равновесии. Это значит, что одновременно конденсируется и испаряется одинаковое количество вещества.
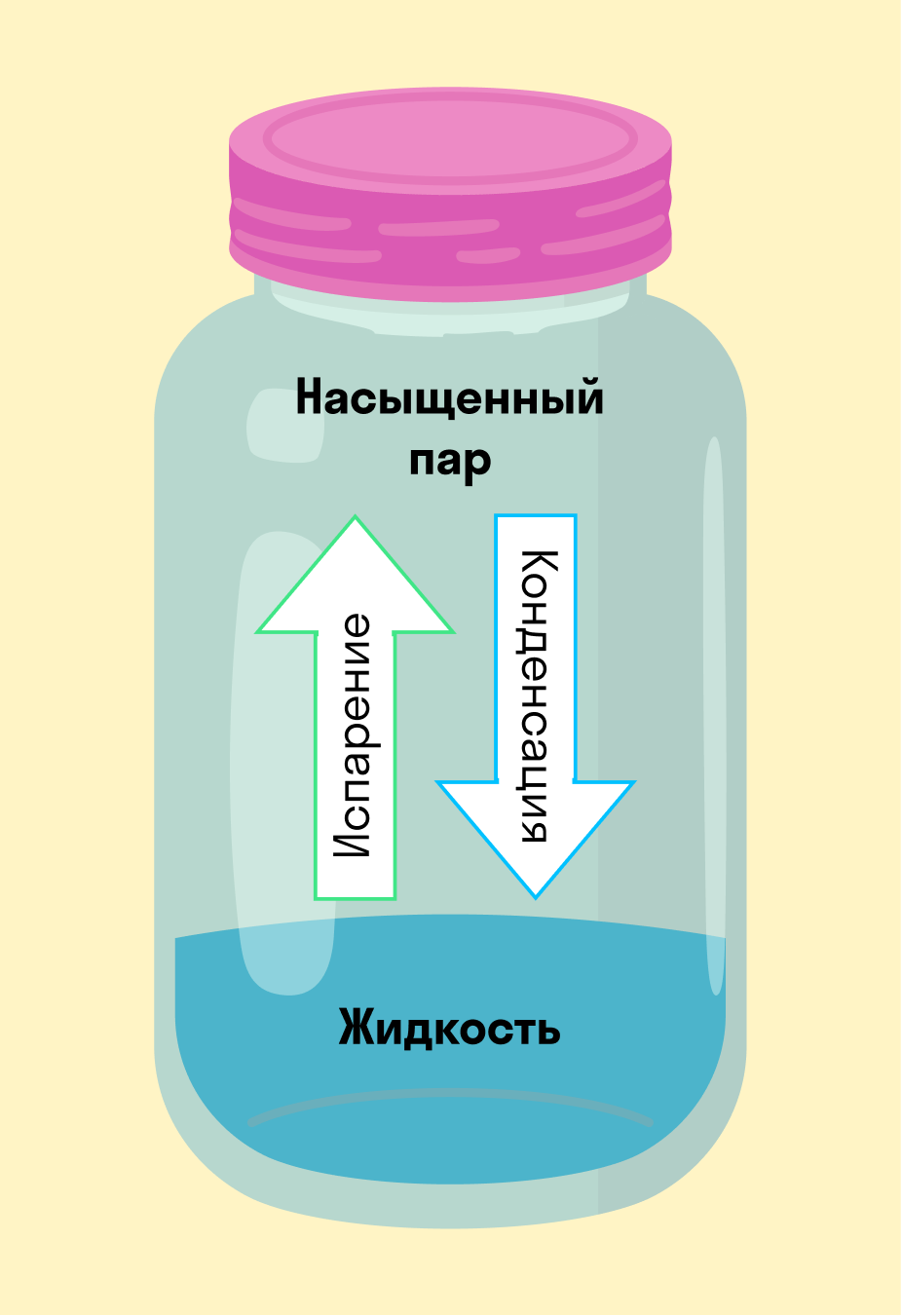
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Но бесконечное количество пара в воздух не запихнешь. Поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре -20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь.
Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40-50%.
Испарение в жизни
И действительно: чего в этой жизни только не испаряется — мы встречаемся с этим каждый день. Давайте узнаем, зачем этот процесс вообще нужен, и как люди научились извлекать из него пользу.
Испарение в организме человека и животных
Выше мы разбирали вопрос, почему если облиться теплой водой, нам все равно станет холодно. По этому же принципу работает ощущение холода после того, как мы вспотели — в какой-то момент нам становится холодно.
Само потоотделение — важный процесс терморегуляции организма. Если мы достигаем высокой температуры (из-за внешних воздействий или же из-за болезни), то организм стремится себя охладить, чтобы не умереть из-за превращения белков в нашем организме в яичницу.
Пот выделяется через поры кожи, а затем испаряется — все это позволяет нашему организму быстро избавиться от лишней энергии, охладить тело и нормализовать температуру.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой и «скинуть» избыточное тепло, но при высокой влажности пот не может испариться.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно. А при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
У животных этот механизм работает схожим образом. Но, например, собакам испарения с кожи недостаточно, поэтому они часто открывают пасть, высовывают язык и дышат порой ну очень смешно 🐶
Именно гортань и язык собаки идеально подходят для испарения влаги и охлаждения тела животного.
Испарение у растений
Удивительно, но у растений механизм испарения тоже работает схожим образом. Растения очень любят воду, поэтому домашние растения мы поливаем, а в пустынях их просто нет.
Ту воду, которую цветы поглотили, они могут испарять, чтобы не перегреться под жарким солнцем. Да, вода нужна, чтобы растения питались, но в жаркие дни еще и для температурной саморегуляции. Поэтому не забывайте поливать цветы, а в очень жаркие дни делайте это еще интенсивнее.
Испарение в природе и окружающей среде
Процесс испарения напрямую связан с круговоротом воды в природе. Именно круговоротом воды в природе обеспечивается жизнь на Земле — так как влага разносится по всему миру, растения в дикой природе способны жить без наших попыток полить большую пальму из леечки.
Испарение воды с поверхности рек, озер, морей и океанов создает дождевые тучи, которые затем, проливаясь дождем, поливают растения и деревья. Многие дождь не любят, мол, он мокрый, мерзкий и затекает в ботинки, но он очень нужен засушливым регионам — Северной Африке или Центральной Индии, которые часто страдают от засухи.
Испарение в промышленности и быту
С бытом совсем все просто: мы сушим вещи, готовим еду, покупаем увлажнители воздуха или размазываем разлитую лужу по полу.

В случае с промышленностью для нас все не так очевидно. Промышленная техника, работающая на основе испарения, разрабатывается по схожей схеме: в ней всегда максимально увеличена площадь поверхности жидкости, чтобы испарение шло интенсивно.
Например, испаритель, изображенный на схеме, состоит из совокупности соединенных между собой испарителей. В основе его действия — пар, полученный в одной ступени, который используют в качестве источника тепла для следующей ступени. По мере того, как температура уменьшается от одной ступени к другой, вакуум увеличивается, так что температура кипения становится ниже и испарение поддерживается. Он предназначен для того, чтобы очистить воду от отходов.
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
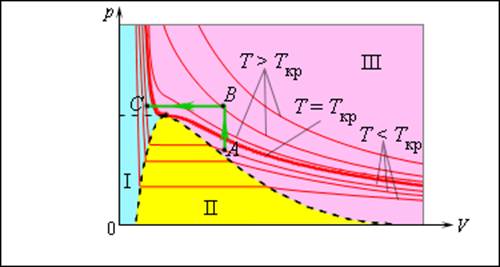
Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T 6 –10 7 ) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p насыщенного пара определяется по кривой равновесия p(T) для данного вещества.
Давление p насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p (T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p (T) можно определять температуру кипения жидкости при различных давлениях.
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
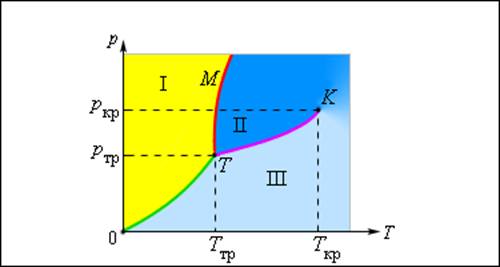
Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество
Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 10 5 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·10 2 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Парообразование и конденсация
Жидкости могут превращаться в пар – такой процесс называют парообразованием. Существует и обратный процесс – конденсация, во время которого молекулы пара возвращаются в жидкость. Разберем эти процессы подробнее.
Процесс образования пара — парообразование
Жидкости имеют свойство переходить из жидкого состояния в газообразное — пар. Превращение жидкости в пар называется парообразованием.
Примечание: Словосочетание «Образование пара» физики часто заменяют словом «Парообразование».
Парообразование – это превращение жидкости в пар (газ).
Нальем в емкость какую-либо жидкость — например, воду, эфир, спирт, бензин, и т. п. Если не накрывать емкость крышкой, то через некоторое время количество жидкости в емкости уменьшается. Это происходит из-за парообразования.
Когда парообразование происходит на поверхности, его называют испарением.
Испарение – это образование пара на поверхности жидкости. Жидкости испаряются при любой температуре.
Примечание: Жидкости могут превращаться в пар с помощью двух процессов – испарения и кипения (ссылка).
Что происходит во время испарения
Во время испарения:
- с поверхности тела вылетают молекулы;
- улетающие молекулы уносят с собой часть внутренней энергии этого тела.

Почему при быстром испарении температура жидкости ощутимо понижается
Мы знаем, что температура влияет на скорость движения молекул.
При одной и той же температуре скорости соседних молекул немного различаются. Одни молекулы будут двигаться несколько быстрее других.
Часть молекул будет двигаться насколько быстро, что преодолеет притяжение соседних молекул жидкости и покинет ее. Такие молекулы испаряются и уносят с собой энергию.
Испарение – это эндотермический процесс. Он происходит с поглощением энергии.
Куда тратится полученная энергия? Ее забирают с собой испарившиеся молекулы, вылетевшие из жидкости.
Примечание: Из-за потерь тепловой энергии при испарении температура жидкости понижается. Чем быстрее испаряется жидкость, тем сильнее понижается ее температура.
Если же испарение происходит медленно, то потери теплоты успевают восполниться. Молекулы окружающего воздуха будут отдавать часть своей (тепловой) энергии молекулам жидкости и ее температура значительно понижаться не будет.
При быстром испарении температура жидкости понижается, а при медленном –значительно понижаться не успевает, так как теплопотеря восполняется из окружающей среды.
Могут ли испаряться твердые тела
Испаряются не только жидкости, но и твердые тела.
Жителям северных районов известно, что кусочки льда, не прикрытые снегом, со временем уменьшаются в размерах. Происходит выветривание льда. Лед испаряется даже при минусовой температуре воздуха.
Испаряются не только жидкости, но и твердые тела. Испарение твердых тел физики называют словом «сублимация» (или взгонка).
От чего зависит скорость испарения
Скорость, с которой вещество испаряется, зависит от:
- силы, с которой молекулы вещества притягиваются к соседним молекулам (род вещества),
- площади поверхности жидкости,
- движения воздуха над поверхностью жидкости (дует ли ветер, или нет),
- температуры (чем выше температура, тем интенсивнее испарение).
Рассмотрим влияние каждого из этих факторов подробнее.

Как влияет на испарение род вещества
Из жизненного опыта известно, что некоторые жидкости испаряются быстрее, другие — медленнее.
Возьмем воду и ацетон при одинаковой температуре и сравним скорости их испарения.
Если капнуть ацетон на руку, он начнет быстро испаряться и в месте контакта мы будем ощущать холод.
Примечание: Ощущение холода возникает из-за того, что испаряющиеся молекулы уносят с собой тепловую энергию.
А если руку смочить водой, то значительного ощущения холода не возникает.
Вода будет испаряться медленнее, потому, что молекулы воды притягиваются друг к другу сильнее, чем молекулы ацетона. Из-за этого, скорость испарения воды меньше скорости, с которой испаряется ацетон.

Примечание: Обычно, вместо фразы «Молекулы притягиваются сильно» физики говорят: «Потенциальная энергия взаимодействия молекул велика».
Быстро испаряющиеся вещества химики иногда называют летучими. Примерами таких летучих веществ могут служить медицинский спирт, бензин, ацетон и т. п. Такие вещества хорошо испаряются, потому, что невелики силы притяжения между их молекулами.
Скорость испарения зависит от рода вещества. В быстро испаряющихся веществах малы силы притяжения между молекулами.
Как влияет на испарение движение воздуха над поверхностью
Скорость испарения жидкости возрастает, когда воздух над ее поверхностью приходит в движение.
Некоторые испаряющиеся молекулы не имеют запаса кинетической энергии, чтобы улететь подальше от своей жидкости. Они остаются близко к поверхности и спустя какое-то время возвращаются назад в жидкость. Движение воздуха эти вылетевшие молекулы подхватывает и уносит, не давая им вернуться назад. Из-за этого, скорость испарения жидкости увеличивается.

Если подуть на мокрую руку, мы почувствуем ощущение прохлады отчетливее. Возникшее движение воздуха увеличило количество испаряющихся молекул. И теперь из жидкости уходит больше тепловой энергии. Это повлияло на усиление ощущения холода.
Когда над поверхностью жидкости движется воздух, жидкость испаряется быстрее.
Как влияет на испарение площадь поверхности жидкости
Нальем одинаковое количество воды в стакан и в блюдечко. Оставим эти емкости на столе на некоторое время. Через несколько дней мы заметим, что в стакане количество воды уменьшилось, а из блюдца вода испарилась полностью. Вода из блюдца испарилась быстрее, потому, что имела большую площадь поверхности.

Процесс испарения происходит у поверхности жидкости. Поэтому, чем больше поверхность жидкости, тем быстрее будет испаряться жидкость.
Скорость испарения жидкости зависит от площади ее поверхности. Чем больше площадь поверхности, тем быстрее испаряется жидкость.
Как влияет на испарение температура
Жидкости испаряются при любой температуре. А с ростом температуры скорость испарения возрастает. Потому, что возрастает количество молекул, обладающих энергией, достаточной, чтобы покинуть жидкость.

Примечание: Зависимость испарения от температуры в некоторых учебниках описывают так: При повышении температуры все большее количество молекул жидкости имеют кинетическую энергию, превышающую потенциальную энергию взаимодействия с соседними молекулами. Поэтому, с ростом температуры, скорость испарения жидкости возрастает.
Скорость испарения жидкости зависит от ее температуры. Чем выше температура, тем быстрее испаряется жидкость.
Примечание: Процесс образования пара в одних случаях называют испарением, а в других – кипением (ссылка).
Какой пар называют насыщенным
Из-за испарения воздух над жидкостью всегда содержит какое-то количество молекул, вылетевших из жидкости. Некоторые из испарившихся молекул могут вернуться обратно в жидкость. Рассмотрим процесс испарения и возвращения молекул подробнее. Для этого сопоставим, как происходит испарение в закрытом и открытом сосудах.
Сравним испарение в открытом и закрытом сосудах
Рассмотрим сосуд, например, кастрюльку, в которой происходит испарение жидкости.
Поначалу накрывать крышкой ее не будем. Молекулы, вылетевшие из открытого сосуда, будут уноситься движением окружающего кастрюльку воздуха. Благодаря этому масса жидкости в открытом сосуде со временем уменьшится.
Если же емкость накрыта крышкой (пробкой), то часть испарившихся молекул будет возвращаться обратно в жидкость. Потому, что в закупоренном сосуде нет движения больших масс воздуха над жидкостью. Поэтому, некоторые из испарившихся молекул вернутся из воздуха обратно в жидкость.
Масса жидкости, находящейся в закупоренном сосуде, со временем не меняется. Поэтому, жидкости хранят в сосудах, плотно закупоренных пробками.
Что такое динамическое равновесие пара и жидкости
Пусть жидкость находится в закрытом сосуде и испаряется. Поначалу, количество испаряющихся молекул увеличивается. Плотность пара, находящегося над жидкостью, возрастает.
Некоторые из вылетевших молекул возвращаются обратно в жидкость. Но при этом число вылетевших молекул, больше числа вернувшихся обратно.
Пар над жидкостью ненасыщенный, когда число вылетевших молекул больше числа вернувшихся в жидкость.
Время течет и плотность пара над жидкостью продолжает возрастать. Будет возрастать и количество вернувшихся в жидкость молекул.
А когда число вылетевших молекул сравняется с числом вернувшихся, плотность пара станет максимальной.
Теперь, если несколько молекул вылетит из жидкости, то такое же количество других молекул из пара вернется обратно в жидкость.
Такое состояние пара и жидкости называют динамическим равновесием. А пар называют насыщенным.

Пар над жидкостью насыщенный, когда число вылетевших молекул равно числу вернувшихся в жидкость. Такое состояние пара и жидкости — динамическое равновесие. Плотность насыщенного пара – самая высокая при любой выбранной температуре. Чем выше температура, тем больше будет плотность насыщенного пара.
Примечание: Плотность – это масса в объеме. Плотность измеряют в килограммах, деленных на кубический метр. Плотность отвечает на вопрос: «Какова масса одного кубометра вещества?».
Где применяется испарение
Благодаря испарению высыхают развешенные для просушки постиранные вещи.
На электро- и теплостанциях используются большие испарительные колонны – градирни. Они, благодаря испарению, охлаждают большое количество воды, использующейся там для технических нужд.
В кондиционерах и холодильниках применяют высоко летучие жидкости. Испаряясь, эти жидкости охлаждают воздух в помещениях или продукты, хранящиеся внутри холодильника.
И даже в космонавтике процесс испарения играет важную роль. Корпуса спускаемых космических аппаратов покрывают веществами, способными быстро испаряться. Проходя через атмосферу, оболочка капсулы разогревается. А вещество покрытия, испаряясь, охлаждает капсулу и спасает находящихся внутри космонавтов от действия высоких температур.
Что такое конденсация
Если закупоренный прозрачный сосуд с водой из теплого места переместить в прохладное, то через некоторое время на стенках этого сосуда появятся капельки.
Капли жидкости на стенках появляются потому, что существует процесс, обратный испарению. Во время такого процесса молекулы из пара возвращаются обратно в жидкость.
Свое название – конденсация — этот процесс получил от латинского слова «Конденсаре» — сгущать.
Конденсация – это переход молекул из пара в жидкость, процесс обратный парообразованию.

Круговорот воды в природе происходит благодаря процессам конденсации и испарения. Конденсация – это причина появления росы и осадков.
Что происходит во время конденсации
Во время конденсации происходит смена агрегатного состояния вещества:
- молекулы пара из воздуха возвращаются обратно в жидкость;
- возвратившиеся молекулы приносят с собой энергию, которая при их переходе в жидкость передается в окружающее пространство.
Дело в том, что молекулы, находящиеся в жидкости, будут двигаться медленнее молекул пара. Когда молекулы пара конденсируются в жидкость, их кинетическая энергия уменьшается. Излишки энергии передаются в окружающую среду.
Процесс конденсации – экзотермический процесс, потому, что при конденсации в окружающую среду выделяется энергия.
Парообразование и конденсация в физике – основные понятия, формулы и определение с примерами
Содержание:
- Каковы особенности испарения жидкости
- Какой пар называют насыщенным
- От каких факторов зависит давление насыщенного пара
- Как и почему кипит жидкость
- От каких факторов зависит температура кипения жидкости
- Какой пар называют насыщенным
Парообразование и конденсация:
Любое вещество при определенных условиях может переходить из одного фазового (агрегатного) состояния в другое. Влажная одежда может «замерзнуть», а может высохнуть, водяной пар может собраться в капельки воды, образуя туман или росу, а может превратиться в иней. Вспомним, при каких условиях происходит переход вещества из жидкого состояния в газообразное и наоборот.

Каковы особенности испарения жидкости
Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием.
Есть два способа перехода жидкости в газ: испарение и кипение.
Испарение — это процесс парообразования с поверхности жидкости.
С точки зрения МКТ парообразование — это такой процесс, когда с поверхности жидкости вылетают быстрые молекулы. Действительно, молекулы жидкости непрерывно движутся (колеблются около положений равновесия, время от времени перепрыгивают с места на место), но силы притяжения не дают им разлететься. Однако в жидкости всегда есть молекулы, кинетическая энергия которых в несколько раз превышает ее среднее значение. Когда эти «быстрые» молекулы оказываются на поверхности жидкости, их энергии хватает для того, чтобы, преодолев притяжение соседних молекул, покинуть жидкость.
Зная механизм испарения, отметим некоторые его особенности.
- Испарение происходит при любой температуре. Чем выше температура жидкости, тем больше в ней «быстрых» молекул, поэтому с увеличением температуры скорость испарения увеличивается. Поскольку жидкость покидают молекулы, кинетическая энергия которых выше средней, то средняя кинетическая энергия оставшихся молекул уменьшается, то есть при отсутствии теплообмена процесс испарения вызывает охлаждение жидкости.
- Испарение сопровождается поглощением энергии: энергия расходуется на совершение работы против сил межмолекулярного притяжения и сил внешнего давления. Чем меньше давление на свободную поверхность жидкости, тем быстрее жидкость испаряется.
- Скорость испарения увеличивается при увеличении площади свободной поверхности жидкости (на поверхности жидкости будет больше молекул с достаточной кинетической энергией).
- Разные жидкости испаряются с разной скоростью (спирт испаряется почти мгновенно, вода — медленнее, а капля ртути будет испаряться годами, отравляя воздух). Очевидно, что медленнее испаряются те жидкости, молекулы которых сильнее взаимодействуют друг с другом.
Какой пар называют насыщенным
Скорость испарения зависит от движения воздуха: волосы быстрее высохнут, если их сушить феном; лужи после дождя быстрее исчезнут в ветреную погоду. Такую зависимость легко объяснить с точки зрения теплового движения молекул. Около поверхности жидкости всегда существует «облако» покинувших ее молекул, то есть пар этой жидкости. Молекулы пара беспорядочно движутся, сталкиваясь друг с другом и с молекулами других газов. Благодаря диффузии и движению воздуха некоторые молекулы пара удаляются от поверхности жидкости и уже никогда в нее не возвращаются. Другие молекулы, наоборот, могут оказаться так близко к поверхности, что силы межмолекулярного взаимодействия «захватывают» их и возвращают в жидкость (см. рис. 31.2). Если бы молекулы, покинувшие жидкость, не возвращались, то скорость испарения была бы огромной. Например, при комнатной температуре ведро воды испарилось бы менее чем за час.
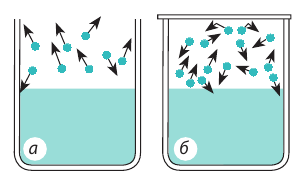
Рис. 31.2. Молекулы, покинувшие жидкость, могут снова вернуться в нее вследствие теплового движения: а — пар над поверхностью жидкости ненасыщенный; б — пар над поверхностью жидкости насыщенный
Таким образом, наряду с процессом испарения, в ходе которого жидкость переходит в пар, существует обратный процесс, в ходе которого вещество из газообразного состояния переходит в жидкое.
Процесс перехода вещества из газообразного состояния в жидкое называют конденсацией.
Испарение сопровождается поглощением энергии; при конденсации энергия выделяется. Закроем крышкой сосуд с некоторым объемом жидкости (рис. 31.2, б). Поверхность жидкости по-прежнему будут покидать «быстрые» молекулы, масса жидкости будет уменьшаться, а концентрация молекул пара — увеличиваться. Одновременно часть молекул будет возвращаться из пара в жидкость. Очень быстро концентрация молекул пара над жидкостью станет настолько высокой, что число молекул, возвращающихся в жидкость, будет равно числу молекул, покидающих ее за то же время, — между процессами конденсации и испарения установится динамическое равновесие.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным паром.
Обратите внимание! Концентрация молекул насыщенного пара — наибольшая возможная концентрация молекул пара при данной температуре; пар, концентрация молекул которого меньше, чем в насыщенном, называют ненасыщенным паром.
От каких факторов зависит давление насыщенного пара
Для насыщенного пара, как и для любого газа, справедливо равенство p=nkT. То есть при данной температуре T давление p насыщенного пара прямо пропорционально концентрации n его молекул.
Поскольку концентрация молекул насыщенного пара зависит от рода жидкости, то и давление насыщенного пара зависит от рода жидкости (табл. 1).
Давление насыщенного пара при 20 °C
| Вещество | Давление, мм рт. ст. |
|---|---|
| Ртуть | 0,0013 |
| Вода | 17,36 |
| Хлороформ | 160,5 |
| Эфир | 442,4 |
| Хлор | 5798 (7,63 атм) |
| Аммиак | 6384 (8,4 атм) |
Чем больше силы межмолекулярного взаимодействия, тем меньше концентрация молекул насыщенного пара и, следовательно, тем меньше его давление. Кроме того, давление насыщенного пара зависит от температуры. При увеличении температуры давление насыщенного пара растет гораздо быстрее, чем давление идеального газа (рис. 31.3).
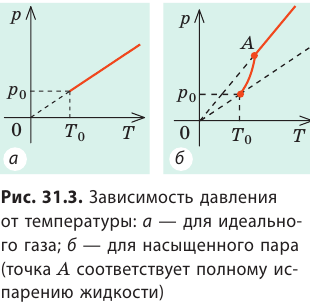
Дело в том, что одновременно с ростом температуры увеличивается концентрация молекул пара.
Обратите внимание! Если повышение температуры приведет к полному испарению жидкости, то в дальнейшем пар станет ненасыщенным и его давление будет линейно зависеть от температуры.
Давление, создаваемое насыщенным паром, — наибольшее давление, которое может создать пар данной жидкости при данной температуре. Если уменьшить объем, занимаемый насыщенным паром, то на короткое время концентрация молекул пара увеличится, динамическое равновесие нарушится и число молекул, поступающих в жидкость, превысит число молекул, покидающих ее.
Конденсация будет преобладать над испарением до тех пор, пока концентрация молекул пара не уменьшится до концентрации молекул насыщенного пара, а давление не станет равным давлению насыщенного пара. С увеличением объема, занимаемого насыщенным паром, наоборот, будет преобладать процесс испарения, и в результате снова установится начальное давление. Таким образом, в отличие от идеального газа, давление насыщенного пара не зависит от его объема (рис. 31.4).
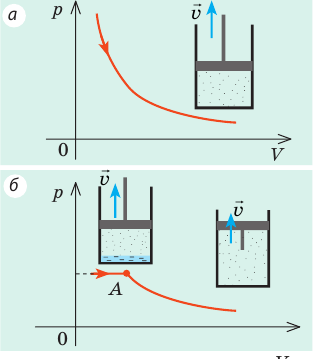
Рис. 31.4. Зависимость давления от объема: а — для идеального газа; б — для насыщенного пара. Точка А соответствует полному испарению жидкости; пар становится ненасыщенным, и его давление уменьшается обратно пропорционально объему
Как и почему кипит жидкость
Если к сосуду с жидкостью подвести достаточное количество теплоты, температура жидкости будет увеличиваться, а дно и стенки сосуда покроются пузырьками. Эти пузырьки содержат воздух и насыщенный пар, давление которых будет расти с ростом температуры. Как только давление газа внутри пузырьков превысит внешнее давление, пузырьки начнут увеличиваться в объеме (рис. 31.5, а).
Рис. 31.5. Механизм кипения жидкости
Наконец под действием архимедовой выталкивающей силы они оторвутся от дна сосуда и начнут всплывать; на месте оторвавшихся пузырьков останется небольшое количество газа — «зародыши» новых пузырьков (рис. 31.5, б).
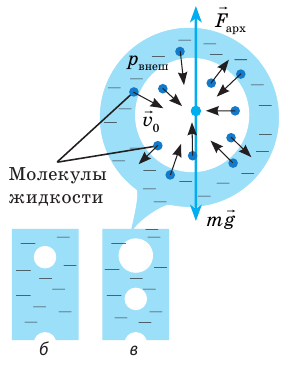
Рис. 31.5. Механизм кипения жидкости
Пока верхние слои жидкости чуть холоднее нижних, в верхних слоях часть водяного пара в пузырьках конденсируется и они «схлопываются». Этот процесс сопровождается шумом и образованием многочисленных мелких пузырьков газа — жидкость «кипит белым ключом». Когда жидкость полностью прогреется, пузырьки, поднимаясь, увеличиваются в объеме, ведь в их середину непрерывно испаряется жидкость (рис. 31.5, в). Достигнув поверхности жидкости, пузырьки лопаются, выбрасывая пар в атмосферу; жидкость при этом бурлит и клокочет — кипит (рис. 31.5, г).
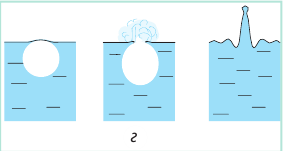
Рис. 31.5. Механизм кипения жидкости
Кипение — процесс парообразования, который происходит по всему объему жидкости и сопровождается образованием и ростом пузырьков пара.
От каких факторов зависит температура кипения жидкости
Продолжая нагревать уже кипящую жидкость, можно заметить, что во время кипения температура жидкости не изменяется (рис. 31.6).
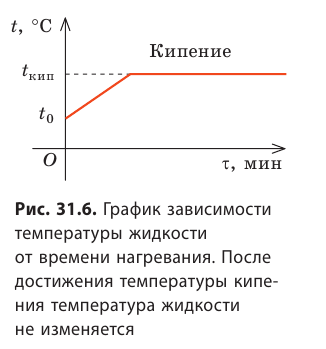
Если увеличить количество теплоты, подводимой к жидкости, то увеличится количество пузырьков, то есть возрастет интенсивность парообразования. Таким образом, при кипении вся подводимая энергия идет на парообразование.
Жидкость начинает кипеть (пузырьки начинают увеличиваться в объеме) только тогда, когда давление газа в пузырьках (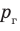 ) становится чуть больше давления в жидкости (
) становится чуть больше давления в жидкости (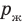 ). В пузырьках содержатся воздух и насыщенный пар, однако воздуха в них гораздо меньше, чем пара, поэтому давление газа в пузырьках примерно равно давлению насыщенного пара
). В пузырьках содержатся воздух и насыщенный пар, однако воздуха в них гораздо меньше, чем пара, поэтому давление газа в пузырьках примерно равно давлению насыщенного пара 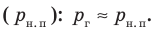 Давление в жидкости складывается из внешнего давления (давления на поверхность жидкости) (
Давление в жидкости складывается из внешнего давления (давления на поверхность жидкости) ( ) и гидростатического давления столба жидкости (ρgh ):
) и гидростатического давления столба жидкости (ρgh ): 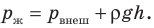 Если глубина сосуда меньше метра, то гидростатическим давлением жидкости можно пренебречь, поэтому
Если глубина сосуда меньше метра, то гидростатическим давлением жидкости можно пренебречь, поэтому 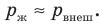
Кипение начинается при температуре, при которой давление насыщенного пара немного превышает внешнее давление.
Чем меньше внешнее давление, тем при более низкой температуре кипит данная жидкость (рис. 31.7). Если налить в колбу воду и насосом откачивать из колбы воздух, то вода закипит даже при комнатной температуре. И наоборот, если необходимо повысить температуру кипения жидкости, ее нагревают в условиях повышенного давления (рис. 31.8).
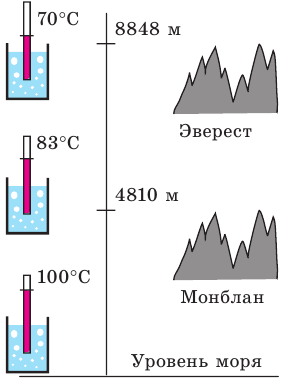
Рис. 31.7. температура кипения воды на разных высотах (и соответственно — при разном давлении)

Рис. 31.8. До высоких температур воду нагревают в автоклавах. При давлении свыше 100 атмосфер температура кипения воды увеличивается до 300 °С
Поскольку давление насыщенного пара зависит от рода жидкости, то при одинаковом внешнем давлении каждое вещество имеет свою температуру кипения (табл. 2).
Температура кипения веществ при нормальном атмосферном давлении
Чем меньше силы межмолекулярного притяжения в жидкости, тем ниже температура ее кипения. Температура кипения жидкости зависит от наличия в ней растворенного газа. Если долго кипятить воду и таким образом удалить из нее растворенный газ, то повторно при нормальном давлении эту воду можно будет нагреть до температуры выше 100 °С.
- Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием. Парообразование может происходить двумя путями: испарением и кипением.
- Испарение — процесс парообразования с поверхности жидкости. Наряду с процессом испарения существует процесс конденсации — процесс перехода вещества из газообразного состояния в жидкое.
- Кипение — процесс парообразования, происходящий по всему объему жидкости и сопровождающийся образованием и увеличением пузырьков пара. Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках немного превышает внешнее давление.
- Если за одинаковое время число молекул, вылетевших с поверхности жидкости, равно числу молекул, вернувшихся в жидкость, то жидкость и ее пар находятся в состоянии динамического равновесия. Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
У всех веществ есть три агрегатных состояния – твердое, жидкое и газообразное, которые проявляются при особых условиях.
Фазовый переход – это переход вещества от одного состояния к другому.
Примерами такого процесса являются конденсация и испарение.
Если создать определенные условия, можно превратить любой реальный газ (например, азот, водород, кислород) в жидкость. Для этого необходимо понижение температуры ниже некоторого минимума, называемого критической температурой. Она обозначается T к р . Так, для азота значение этого параметра равно 126 К , для воды – 647 , 3 К , для кислорода – 154 , 3 К . При поддержании комнатной температуры вода может сохранять как газообразное, так и жидкое состояние, а азот и кислород – только газообразное.
Испарение – это фазовый переход вещества в газообразное состояние из жидкого.
Молекулярно-кинетическая теория объясняет этот процесс постепенным перемещением с поверхности жидкости тех молекул, чья кинетическая энергия больше, чем энергия их связи с остальными молекулами жидкого вещества. Вследствие испарения средняя кинетическая энергия оставшихся молекул уменьшается, что, в свою очередь, приводит к снижению температуры жидкости, если к ней не подведен дополнительный источник внешней энергии.
Конденсация – это фазовый переход вещества из газообразного состояния в жидкое (процесс, обратный испарению).
Во время конденсации молекулы пара возвращаются обратно в жидкое состояние.
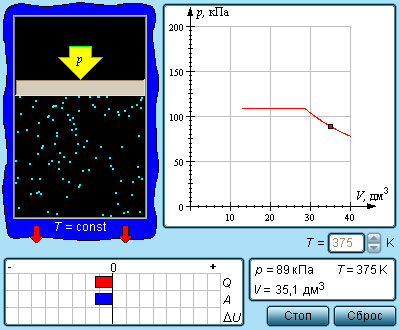
Рисунок 3 . 4 . 1 . Модель испарения и конденсации.
Динамическое равновесие
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Давление насыщенного пара p 0 определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
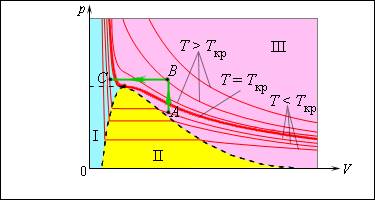
Рисунок 3 . 4 . 2 . Изотермы реального газа. Область I – жидкость, область I I – двухфазная система «жидкость + насыщенный пар», область I I I – газообразное вещество. K – критическая точка.
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T T к р . Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии A B C .
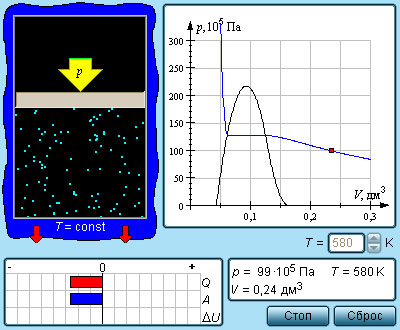
Рисунок 3 . 4 . 3 . Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара ( p ≤ ( 10 6 – 10 7 ) П а ) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Если атмосферное давление нормальное, то для кипения воды нужна температура 100 ° С . При ней давление насыщенных водяных паров будет равно 1 а т м . Если мы будем кипятить воду в горах, то из-за уменьшения атмосферного давления температура кипения снизится до 70 ° С .
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
Кривые равновесия состояний вещества
На изображении выше с помощью изотерма реального газа показаны процессы фазовых переходов – конденсации и испарения. Эта схема является неполной, поскольку вещество может принимать также и твердое состояние. Достижение термодинамического равновесия между фазами вещества при заданной температуре возможно лишь при определенном давлении в системе.
Кривая фазового равновесия – это зависимость между равновесным давлением и температурой.
Примером такой зависимости может быть кривая равновесия жидкости и насыщенного пара. Если мы построим кривые, отображающие равновесие между фазами одного вещества, на плоскости, то мы увидим определенные области, которые соответствуют разным агрегатным состояниям вещества – жидкому, твердому, газообразному. Кривые, построенные в системе координат, называются фазовыми диаграммами.
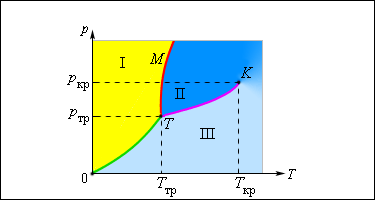
Рисунок 3 . 4 . 4 . Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область I I – жидкость, область I I I – газообразное вещество.
Равновесие между газообразной и твердой фазой вещества отображает так называемая кривая сублимации (на рисунке она обозначена как 0 T ), между паром и жидкостью – кривая испарения, которая заканчивается в критической точке. Кривая равновесия между жидкостью и твердым телом называется кривой плавления.
Тройная точка – это точка, в которой сходятся все кривые равновесия, т.е. возможны все фазы вещества.
Многие вещества достигают тройной точки при давлении меньше 1 а т м ≈ 10 5 П а . Они плавятся при нагревании в атмосферном давлении. Так, у воды тройная точка имеет координаты T т р = 273 , 16 К , p т р = 6 , 02 · 10 2 П а . Именно на ней основана абсолютная температурная шкала Кельвина.
У некоторых веществ достижение тройной точки происходит и при давлении выше 1 а т м .
Например, для углекислоты нужно давление в 5 , 11 а т м и температура T т р = 216 , 5 К . Если давление равно атмосферному, то для поддержания ее в твердом состоянии нужна низкая температура, а переход в жидкое состояние становится невозможен. Углекислота в равновесии со своим паром при атмосферном давлении называется сухим льдом. Это вещество не способно плавиться, а может только испаряться (сублимировать).
Испарение и конденсация
Урок 12. Физика 8 класс (ФГОС)


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока “Испарение и конденсация”
На прошлых уроках мы с вами говорили о том, что существует три агрегатных состояния вещества — твёрдое, жидкое и газообразное.
И выяснили, что при агрегатных превращениях возможны переходы вещества из одного агрегатного состояния в другое.
На этом уроке мы рассмотрим процесс превращения жидкости в газ, и обратное превращение вещества из газообразного состояния в жидкое.
Задумывался ли кто-нибудь из вас над вопросом: почему сохнет мокрая одежда? И почему в ветреную погоду она высыхает значительно быстрее, чем в тихую и прохладную? А если оставить открытым флакон духов, то очень скоро он может оказаться пустым. Почему? Попытаемся ответить на эти и некоторые другие вопросы.
Для начала давайте вспомним, что молекулы вещества в любом его агрегатном состоянии находятся в непрерывном движении. Их скорости меняются самым случайным образом.
Так, например, молекула жидкости, имеющая большую скорость, несомненно обладает и большой кинетической энергией. Такая молекула может преодолеть силы притяжения к другим молекулам и покинуть жидкость. А так как молекулы с большой энергией есть всегда, то со временем количество жидкости будет уменьшаться, а над жидкостью будет образовываться пар.

Явление превращения жидкости в пар называется парообразованием.
Водяной пар невидим. А то, что мы свами часто ошибочно называем паром — например, белёсую струю, выходящую из кипящего чайника, — это не пар, а туман. Он состоит из крошечных капелек воды, образовавшихся при конденсации пара. Но об этом явлении мы поговорим позже.
Отличают два вида парообразования — это испарение и кипение. Они осуществляются при разных условиях.
Испарение — это парообразование, идущее со свободной поверхности жидкости.
А от чего зависит скорость испарения жидкости? Чтобы ответить на этот вопрос, давайте с вами проведём следующий опыт. На стекло нанесём тампоном влажные пятна одинаковых размеров в такой последовательности: подсолнечное масло, вода, ацетон. И проследим, какая жидкость испарится первой.

Через некоторое время мы заметим, что первым исчезнет пятно ацетона, затем воды, и позже всех — подсолнечного масла. Следовательно, скорость испарения зависит от рода жидкости. Это и понятно, ведь у разных жидкостей силы взаимодействия молекул неодинаковые.
Продолжим опыт. Одну стеклянную пластинку возьмём холодную, а другую нагреем. И нанесём на них две одинаковые капли воды.

С нагретого стекла капля исчезнет быстрее, чем с холодного.
И это неудивительно, поскольку чем выше температура жидкости, тем больше скорость движения её молекул, и, соответственно, их кинетическая энергия. Следовательно, большее число молекул способно преодолеть силы притяжения и выйти за пределы поверхности жидкости.
Значит, скорость испарения жидкости зависит от её температуры: чем она выше, тем скорость испарения жидкости больше.
А теперь капнем на стекло две капли ацетона. Размажем одну каплю так, чтобы образовалось пятно, и проследим за изменениями.

Через некоторое время мы заметим, что пятно ацетона испарится быстрее, чем капля. Это объясняется тем, что площадь поверхности пятна больше, чем капли. Следовательно, большее число молекул сможет оказаться на поверхности и, преодолев силы притяжения, вылететь из неё. Значит, чем больше площадь свободной поверхности жидкости, тем больше скорость её испарения.
И наконец, на два стекла нанесём по капле воды, но одно стекло будем обдувать вентилятором.
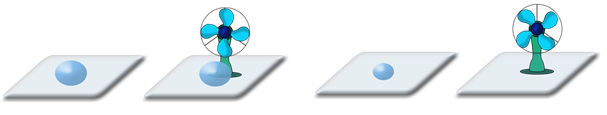
Капля со стекла, обдуваемого вентилятором испарится гораздо быстрее. Почему? Всё дело в том, что при испарении молекулы не только покидают поверхность жидкости, но и возвращаются обратно. А поток воздуха уносит вылетевшие из жидкости молекулы, освобождая место другим. Таким образом, скорость испарения зависит от движения воздуха над свободной поверхностью жидкости.
А теперь выясним, что же происходит с жидкостью в сосуде при испарении. Для этого проделаем такой опыт. Возьмём термометр и обмотаем его конец ватой, смоченной водой, а лучше спиртом.
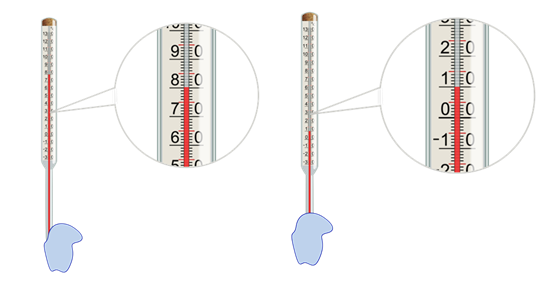
Мы практически сразу заметим, как столбик жидкости в термометре начнёт опускаться. Это свидетельствует об уменьшении температуры жидкости при испарении.
Объясняется этот факт следующим образом. При испарении жидкость покидают молекулы, обладающие наибольшей энергией. Это означает, что внутренняя энергия оставшейся части жидкости уменьшается. Поэтому, если нет притока энергии к жидкости извне, температура испаряющейся жидкости уменьшается.
Мы рассмотрели процессы испарения жидкостей. Однако у вас может возникнуть закономерный вопрос: «А испаряются ли твёрдые тела?».
Для ответа на него, проведём следующий опыт. Поместим в пробирку кристаллики йода и будем нагревать над пламенем спиртовки. Через некоторое время мы заметим, как кристаллики йода начнут испаряться.
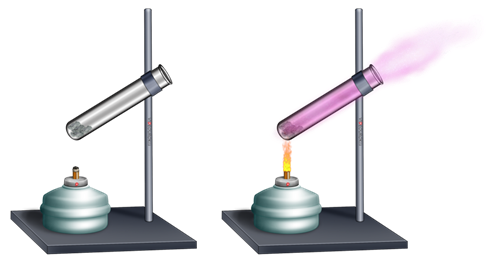
Значит, твёрдые тела тоже испаряются. Этим и объясняется то, что в ясный морозный день исчезает иней на деревьях, а бельё способно высохнуть даже в очень сильный мороз.
В самом начале мы говорили о том, что очень часто люди ошибочно называют паром туман, который состоит из крошечных капелек воды.

Так же все вы не раз наблюдали, как вечером, после жаркого летнего дня, выпадает роса. Это водяной пар, содержащийся в воздухе, при охлаждении превращается в жидкость, и капельки воды оседают на листьях и траве.
Процесс превращения вещества из газообразного состояния в жидкое называют конденсацией (от латинского «сгущать»).
Если процесс испарения идёт быстрее, чем процесс конденсации, то масса жидкости в сосуде уменьшается. Но почему тогда в плотно закрытой банке с водой уровень воды остаётся неизменным? Разве в закрытом сосуде молекулы не вылетают из воды?
Вылетают, конечно. Но из закрытого сосуда они вылететь не могут, поэтому, полетав над жидкостью, многие молекулы возвращаются обратно в жидкость. То есть одновременно с испарением происходит и конденсация.
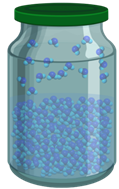
А то, что уровень жидкости в закрытом сосуде остаётся неизменным, означает, что в таком сосуде процессы парообразования и конденсации идут с одинаковой скоростью. Говорят, что в этом случае наступает динамическое равновесие между жидкостью и паром. При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испарятся.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Пар, который не находится в состоянии динамического равновесия со своей жидкостью, называют ненасыщенным паром.
А теперь давайте поставим наш закрытый сосуд, в котором жидкость и пар находятся в состоянии динамического равновесия, над спиртовкой и будем нагревать его.
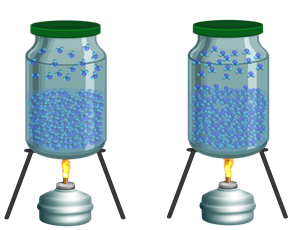
При увеличении температуры, количество молекул, способных вылететь с поверхности жидкости, возрастает. Поэтому в начале количество молекул, покидающих жидкость, будет больше, чем тех, которые возвращаются обратно. Соответственно, нарушается динамическое равновесие и пар перестаёт быть насыщенным.
Однако через какое-то время равновесие вновь восстановится. Но так как число молекул в единице объёма пара увеличится, то увеличится и плотность насыщенного пара. А мы уже знаем, что при увеличении плотности газа возрастает и его давление. Значит, с увеличением температуры, плотность и давление насыщенного пара увеличиваются.
Альфа, бета, гамма-излучения – свойства, примеры воздействия
- ЖАНРЫ 360
- АВТОРЫ 278 480
- КНИГИ 657 961
- СЕРИИ 25 231
- ПОЛЬЗОВАТЕЛИ 614 277
Занимательная радиация. Всё, о чём вы хотели спросить: чем нас пугают, чего мы боимся, чего следует опасаться на самом деле, как снизить риски
Все права защищены. Никакая часть данной книги не может быть воспроизведена в какой бы то ни было форме без письменного разрешения владельцев авторских прав.
© OOO «СУПЕР Издательство» 2017
© Александр Константинов 2017
Сегодня о радиации не говорит и не пишет лишь ленивый. Сотни книг, тысячи статей, радио- и телепередач посвящены этой теме. Зачем понадобилась ещё одна книга? С чего автор вдруг решил, что она заинтересует читателей?
Дело тут вот в чём: большая часть книг и статей о радиации написана либо профессионалами для профессионалов, либо журналистами для населения. Первые книги – научные, для обычного человека не очень понятные. А популярные публикации часто грешат предвзятостью. Это либо ужастики, либо скрытая реклама каких-то средств «от радиации». Или наоборот – нечто благостно-успокаивающее. И в отсутствие базовых знаний мы вынуждены принимать на веру то, что предлагают.
Да, существуют учебники. Их взрослый человек читать не будет: скучно. И есть практические брошюры, предназначенные для пострадавших от радиационных аварий. К большинству из нас это не относится.
Целью автора было создание читабельной, лёгкой для понимания книги. Чтобы уйти от занудства учебного изложения, используется форма разоблачения мифов.
Книгу можно читать по-разному. Кого-то интересуют отдельные вопросы. Например, выводит ли спирт радионуклиды и если да, то чем закусывать? Тогда можно читать выборочно. А полная книга научит оценивать радиационную опасность реально, как есть на самом деле. В книге нет сложных формул, мало научных терминов, зато много примеров и рисунков.
Читатели вовсе не обязаны верить автору на слово. И если у кого-то появится желание проверить приведенные сведения, он сможет сделать это по литературным источникам. Ссылки на них приведены в тексте (номера в квадратных скобках), а перечень – в конце каждой главы. Этот перечень включает публикации, рассчитанные на читателей с разным уровнем подготовки.
АРМИР – автоматизированное рабочее место по оценке индивидуального риска
АЭС – атомная электростанция
бэр – биологический эквивалент рентгена
ВАО – высокоактивные отходы
ВВЭР – водо-водяной энергетический реактор
ВУРС – Восточно-Уральский радиационный след
ДДУ – детские дошкольные учреждения
ДПР – дочерние продукты распада радона
ЕРФ – естественный радиоактивный фон
ИДК – индивидуальный дозиметрический контроль
ЛД – летальная доза
МКРЗ – Международная комиссия по радиологической защите
НКДАР ООН – Научный комитет ООН по действию атомной радиации
ОЛБ – острая лучевая болезнь
ОЯТ – отработавшее ядерное топливо
ПД – предел дозы облучения
ПДК – предельно допустимая концентрация
ПО – производственное объединение
РАМН – Российская Академия медицинских наук
РБМК – реактор большой мощности канальный
РГМДР – Российский государственный медико-дозиметрический регистр
Росатом – Государственная корпорация по атомной энергии «Росатом»
РЩЖ – рак щитовидной железы
Т1/2 – период полураспада
твэл – тепловыделяющий элемент
ТЭС – тепловая электростанция
УрО РАН – Уральское отделение Российской Академии наук
ФГУП – Федеральное государственное унитарное предприятие
ХЛБ – хроническая лучевая болезнь
ЧАЭС – Чернобыльская атомная электростанция
чел. – Зв – человеко-зиверт
ЯТЦ – ядерный топливный цикл
Миф первый: радиацию изобрели атомщики, а её первые жертвы – жители Хиросимы и Нагасаки

На самом деле радиоактивность существовала всегда. Люди испокон века жили в условиях так называемого естественного радиоактивного фона (ЕРФ). И всегда мы немного облучались: сверху, снизу и даже изнутри.
До земной поверхности доходит часть космических излучений; ещё мы облучаемся от тех радионуклидов, которые входят в состав Земли-матушки (горные породы содержат уран и торий). И даже в составе нашего тела есть радионуклиды природного происхождения. Другое дело, что до конца 19-го века о существовании радиации даже не подозревали. Но последствия переоблучения проявлялись уже давно.
Первую массовую гибель людей от радиации наблюдали аж в 16-м веке! Австрийские горняки, работавшие на свинцовых копях близ города Иоахимсталь (ныне чешский город Яхимов), умирали в возрасте 30–40 лет от таинственной «горной болезни», или «горняцкой чахотки». Смертность шахтёров в 50 раз превышала смертность остального населения, а местные женщины выходили замуж по нескольку раз.
В то время не знали, что свинцовые руды содержат ещё и уран, и поэтому выделяют радиоактивный радон. Лишь в 1879 году выяснили, что «горная болезнь» – это рак лёгких. А причину болезни установили ещё позже. Кстати, город Иоахимсталь знаменит не только этим. Именно в Иоахимстали чеканили деньги, которые имели хождение во всей Европе. Называли эту крупную серебряную монету – иоахимсталер, сокращенно талер. Позднее «талер» стали произносить как доллар.
А радиоактивность как явление была открыта в конце 19-го века. И скоро люди узнали: радиация может быть смертельно опасной. Уже в 1928 году был создан специальный Комитет по защите от рентгеновских лучей и радия, позднее реорганизованный в Международную комиссию по радиологической защите – МКРЗ (а вы говорите: «Хиросима»).
Первое время МКРЗ занималась проблемой облучённых медиков. Ведь в начале 20-го века многие врачи работали с рентгеновскими лучами. И почти весь их первый отряд погиб от онкологических заболеваний. В 1936 году в Гамбурге им открыли памятник (да-да, в гитлеровской Германии). На нём высечены 186 имён рентгенологов и радиологов всех наций – жертв переоблучения (а вы говорите: «Нагасаки») [1].
Да, в наше время массовые переоблучения чрезвычайно редки. Тем не менее в среднем мы получаем дозу в три-четыре раза больше, чем в стародавние времена. Позднее вы узнаете, что такое доза и насколько опасно такое увеличение. Пока же перечислим главные пути дополнительного облучения современного человека.
Во-первых, мы проходим рентгеновское обследование.

Во-вторых, сегодня мы живём не на открытом воздухе, а в помещениях. И в результате появляются два дополнительных источника облучения. Первый называют внешним облучением от строительных материалов: ведь бетон и кирпич всегда содержат немного урана и тория, а также радиоактивные продукты их распада. Поэтому в каждом килограмме бетона ежесекундно происходит 30–50 радиоактивных распадов, а в килограмме кирпича – 100–150 распадов. По-научному это называется так: «удельная активность бетона составляет 30–50, кирпича – 100–150 беккерелей на килограмм (Бк/кг)».
А второй, более мощный источник облучения, – внутренний, за счёт вдыхаемого радиоактивного радона, который накапливается внутри помещений.
В итоге мы получаем приличную добавку к природному фону. Итак, мы жили, живём и будем жить в радиоактивном мире.

Хорошо это или плохо? Пока примем как данность.






